[Прелесть биологии] Ось "кишечник-мозг"
![[Прелесть биологии] Ось "кишечник-мозг"](/content/images/size/w2000/2021/02/bio6.jpg)
Все статьи из цикла "В чем прелесть предмета"
Другие статьи из цикла "В чем прелесть биологии":
Биологические часы и их часовщики
Биология эгоизма
Секреты микоризы
Наркотики в нашей жизни
Метаболический путь глюкозы
Введение
В предыдущих статьях по биологии мы затрагивали такие общеизвестные концепты, как сон, гены и эгоизм. Сегодняшняя же тема посвящается особой связи между двумя полностью различными и несколько далекими системами – нервной и пищеварительной. Наверняка вы сейчас задаетесь вполне логичным вопросом: для чего нужно изучать взаимодействие мозга с кишечником? В первую очередь, эти знания определенно приведут вас в увлекательный мир анатомии и покажут способы лечения многих заболеваний нервной системы вроде болезни Альцгеймера и болезни Паркинсона. После прочтения этой статьи изменится и ваш взгляд на то, как нужно заботиться о своем здоровье: мы детально рассмотрим, почему важно справляться со стрессом и как это делать, а также разберем, каким образом депрессия отражается на общем состоянии желудочно-кишечного тракта.
Микробиота кишечника
Задумывались ли вы, какое влияние оказывает ваш мозг на процесс пищеварения? На первый взгляд может показаться, что связь между нервной системой и желудочно-кишечным трактом невелика. Однако за долгие годы исследований нашего организма ученые установили, что они образуют единую систему, а сама связь в научном сообществе известна как ось “кишечник-мозг” (от англ. Brain-Gut-Microbiome axis). Оказалось, что кишечная микрофлора (микробиота), в которой обитает огромное разнообразие бактерий, теснейшим образом влияет на центральную нервную систему, а значит и на эмоциональное состояние и самочувствие человека в целом.
Каким образом функционирует ось "кишечник-мозг"?
Тип взаимоотношений между микробиотой кишечника и человеческим организмом – это ярким пример симбиоза, поскольку обе стороны приносят много пользы друг другу. Человек снабжает кишечные бактерии пищей, а те, в свою очередь, синтезируют важные для человека вещества в виде витаминов B и K, а также метаболизируют желчные кислоты и ксенобиотики – чужеродные для организма химические соединения. Эти симбиотические бактерии во многом помогают функционированию желудочно-кишечного тракта.
Для понимания общей целостности функционирования данной системы необходимо провести ее полный разбор с разных точек зрения. Давайте разберем, как именно функционирует ось "кишечник-мозг" с точки зрения биохимии на примере метаболизма триптофана в организме человека. На рисунке 1 кратко описан процесс метаболизма этой чрезвычайно важной аминокислоты.
Метаболизм триптофана проходит по трем различным биохимическим путям. На первом пути (правая ветвь) бактерии, содержащие фермент триптофаназа, превращают триптофан в индол – гетероциклическое ароматическое соединение, входящее в состав гормона ауксина и участвующее в передаче сигнала между клетками.
На втором пути бактерии Clostridium sporogenes сначала превращают триптофан в индол, а затем в \(3\)-индол пропионовую кислоту (IPA), которая выполняет функцию антиоксиданта. Любопытно, что после всасывания через клетки кишечника, IPA деактивирует разрушительные для нервных клеток гидроксильные радикалы, тем самым обеспечивая стабильную работу нервной системы. Также противовоспалительные свойства IPA снижают риск развития ишемии головного мозга и болезни Альцгеймера.
И наконец, нормальное функционирование иммунной системы возможно благодаря третьему метаболическому пути триптофана: здесь происходит синтез вещества, называемого индол-\(3\)-альдегид (I3A) – соединения, способного активировать рецептор, расположенный на мембранной поверхности иммунных клеток кишечника. Это вещество стимулирует естественный синтез интерлейкина-\(22\) (IL-\(22\)) в клетках кишечника, который представляет собой небольшую сигнальную молекулу, участвующую в иммунном ответе. Этот интерлейкин-22 как раз и способствует уменьшению различных воспалений в организме человека.
Вот так кишечная микробиота приносит пользу нашему организму практически на всех фронтах, будь то нервный или иммунный!
Связь микробиоты кишечника с центральной нервной системой
Как известно, регуляция центральной нервной системы идет по двум главным ветвям: нисходящей и восходящей. В регуляции ЦНС важную роль занимают нейроэндокринные механизмы, что означает непосредственное участие кишечной микробиоты в синтезе химических соединений, передающих сигналы за счет взаимодействия с энтероэндокринными (ECC) клетками и иммунной системой слизистой оболочки кишечника. Среди этих синтезированных химических веществ некоторые неполярные молекулы могут преодолевать внеклеточный барьер и, попадая внутрь клеток слизистой кишечника, вступать в происходящие там процессы.
Помимо выработки важных соединений для организма, активирующих внутреннюю передачу сигналов в ЦНС, сигнальные молекулы принимают участие в синтезе нескольких биологически активных веществ, включая гамма-аминомасляной кислоты, норадреналина и дофамина.
Еще один механизм взаимодействия нервной системы с кишечником связан с серотонином, более известным как гормон счастья. Примечательно, что \(95\%\) серотонина в организме находится в клетках эпителия желудочно-кишечного тракта и кишечных нейронах, когда как в пределах ЦНС находится лишь оставшиеся \(5\%\)! Таким образом, микроорганизмы кишечника могут воздействовать на настроение человека, что, в сущности, действует на всю нейронную сеть мозга.
Ранее упомянутый триптофан является предшественником серотонина и других важных метаболитов в оси "кишечник-мозг". Наш организм не способен самостоятельно производить триптофан, поэтому мы получаем его извне – через пищу. Гормон счастья, напротив, синтезируется за счет кишечных бактерий и направляется в клетки мозга.
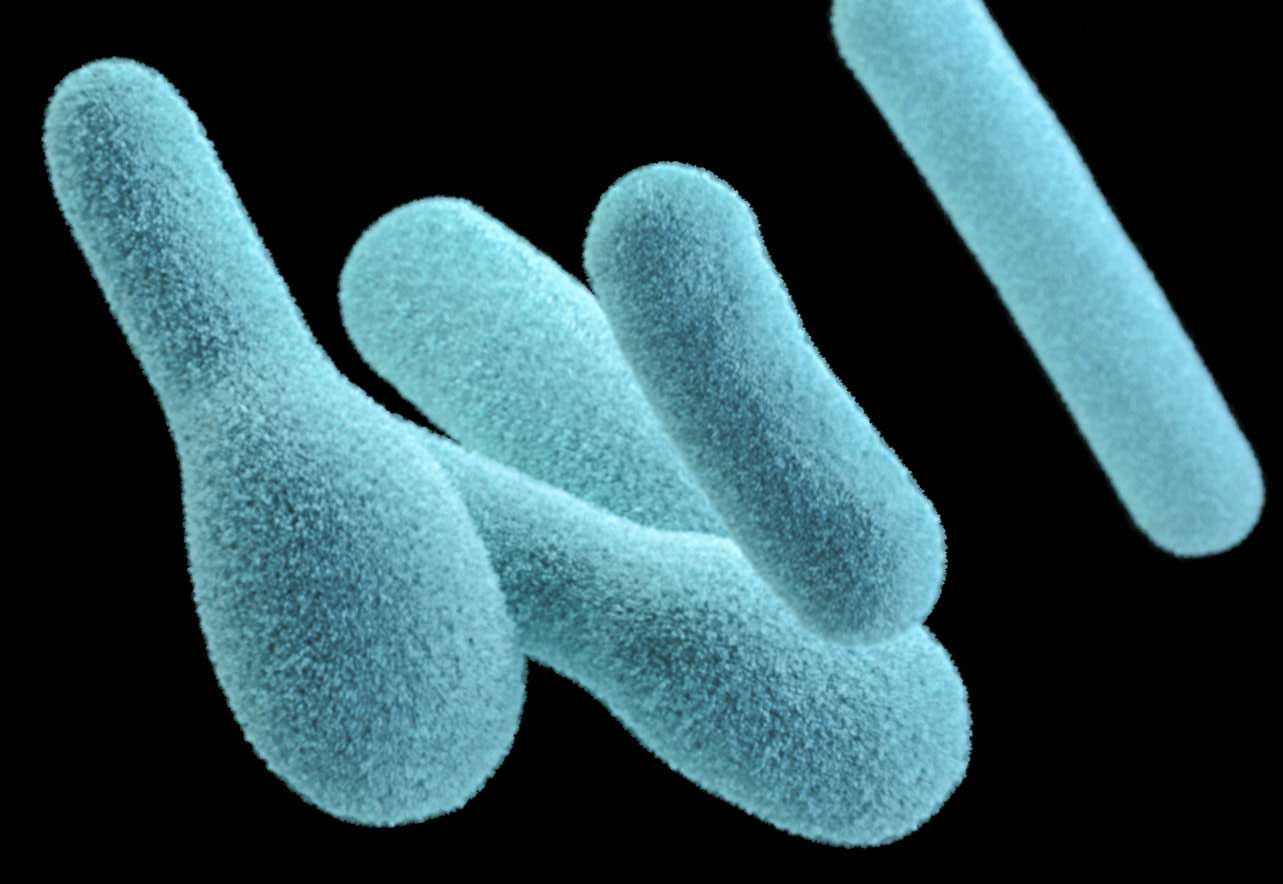
В чем же тогда заключается роль спорообразующих бактерий Clostridium в обеспечении организма необходимыми химическими веществами? На деле бактерии Clostridium синтезируют сигнальные молекулы, которые стимулируют клетки ECC, повышая доступность триптофана для клеток кишечника. По другому пути аксоны вегетативной нервной системы выделяют серотонин в просвет кишечника, после чего гормон уже захватывается кишечной микрофлорой. Получается, этот вид кишечных бактерий напрямую регулирует синтез серотонина в организме.
Чем вызван патогенез болезни Альцгеймера?
Болезнь Альцгеймера характеризуется деменцией, потерей памяти и в редких случаях смертью. Основной причиной развития данного нейродегенеративного заболевания считается формирование нерастворимого белка, так называемого бета-амилоида, в нервных клетках, вследствие чего погибают нейроны, накопившие эти бета-амилоиды. Самое интересное, что даже малейшие изменения в функции кишечной микробиоты, например проникновение патогена или нарушение жизнеспособности полезных бактерий, в силах вызвать дисбаланс иммунной системы человека, что, в свою очередь, может стать причиной накопления бета-амилоида в нейронах, приводящих к нейровоспалению. Каким образом это происходит? Вспомним, что ЦНС имеет связь с кишечником через две ветви регуляции, и именно через восходящую ветвь микрофлора кишечника влияет на когнитивные процессы. Так, у пациентов с деменцией наблюдается корреляция между воспалительными цитокинами и количеством бактерий Escherichia/Shigella, участвующих в воспалении: чем больше бактерий, тем больше воспалительных молекул. Токсичные продукты жизнедеятельности таких патогенных бактерий, безусловно, попадают в мозг, приводя к накоплению амилоидных фибрилл в нейронах.
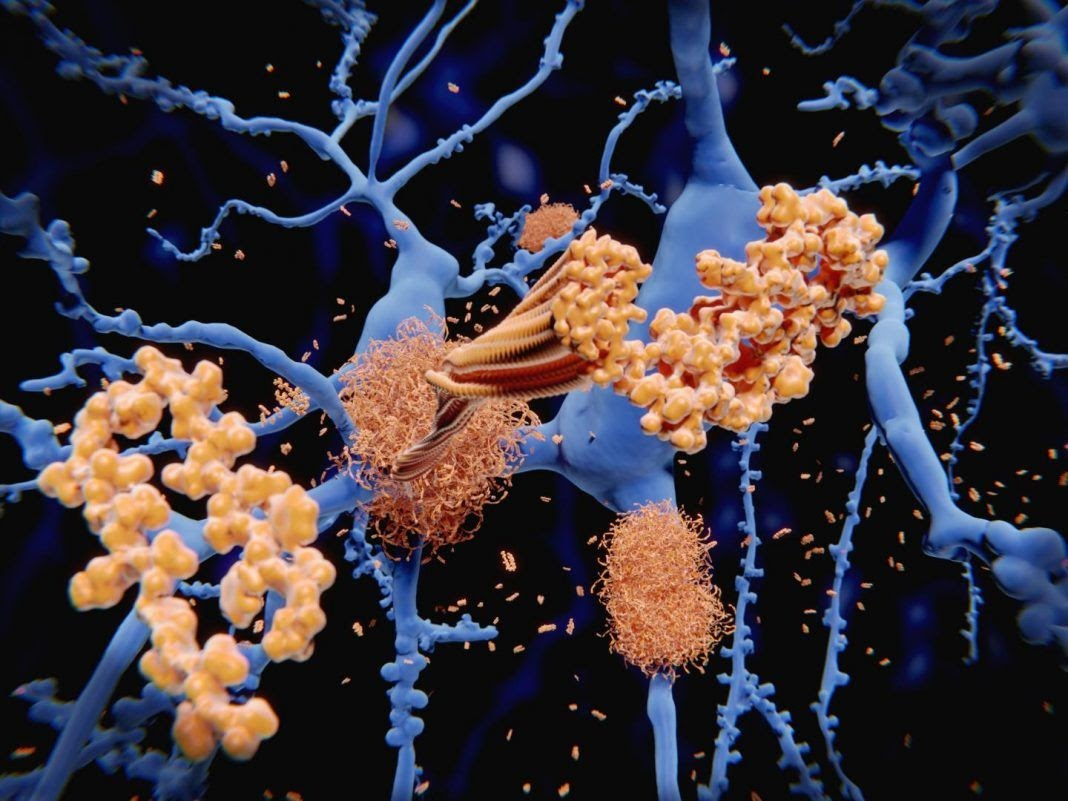
Влияние кишечной микробиоты на воспаление нейронов
Недавно ученые доказали, что кишечная микробиота непосредственно влияет на взаимодействие между ЦНС и кишечником на разных этапах жизни человека. Результаты экспериментов на лабораторных мышах подтверждают влияние кишечной микробиоты на иммунные клетки нервной ткани. С возрастом человеческий организм испытывает перегрузку иммунной системы, которая приводит к серьезным воспалительным процессам в слизистой кишечника. По этой причине исчезает стабильность и разнообразие микробиоты человеческого кишечника, но, что хуже, в случае продолжительного воспаления немедленно происходит разрушение кишечного барьера.
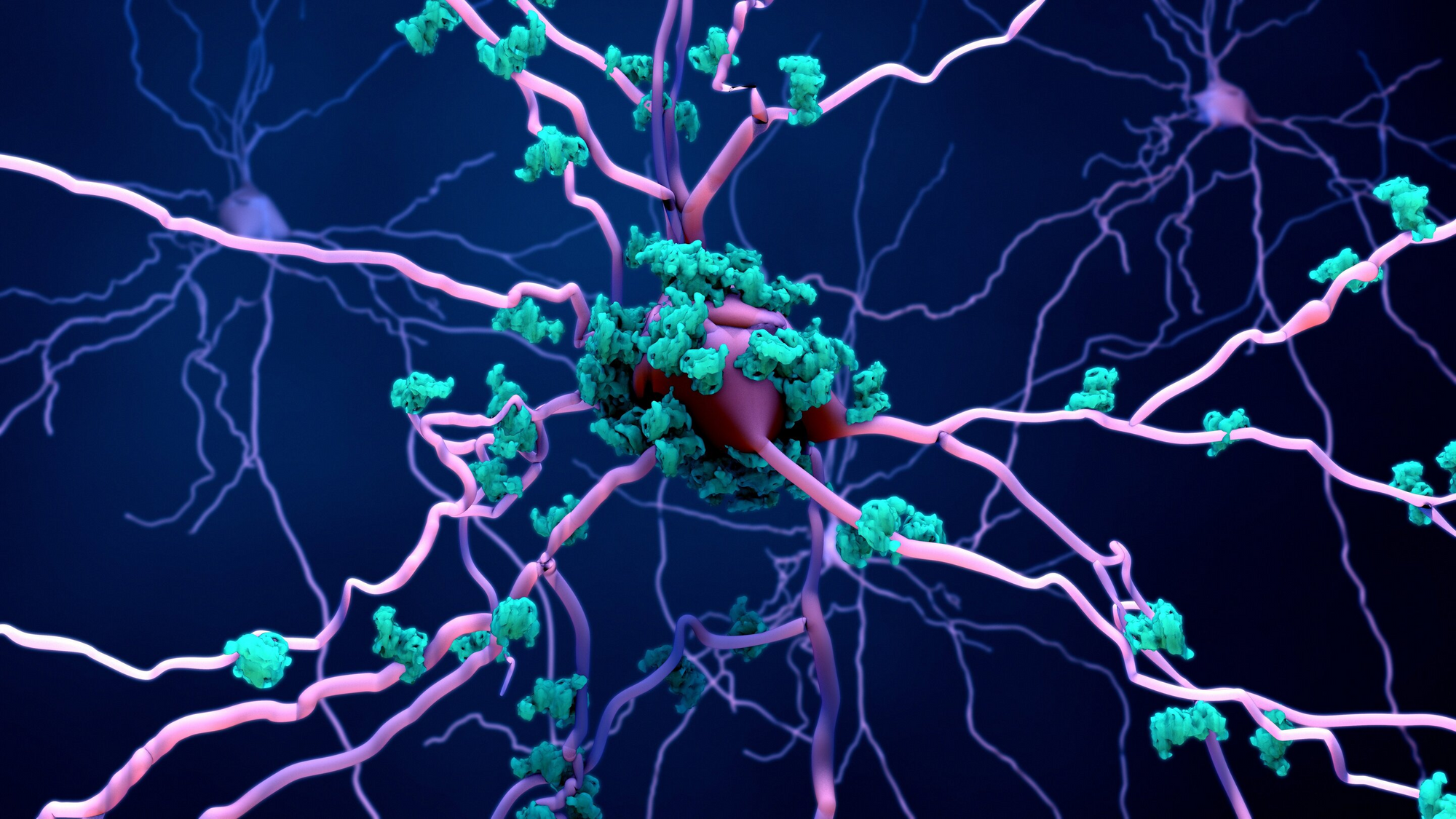
После разрушения кишечного барьера продукты бактериальной активности и воспалительные сигнальные молекулы по кровеносной системе переходят в гематоэнцефалический барьер головного мозга, в результате чего живые нервные клетки повреждаются по мере заражения нейронов токсическими продуктами воспаления. Таким образом, сбой и чрезмерная активность иммунной системы человека приводят к необратимым последствиям для нервной системы человека.
Практическое применение
Последние клинические исследования, посвященные связи мозга и кишечника, показали большой потенциал лечения желудочно-кишечных неврологических расстройств через воздействие на саму ось "кишечник-мозг". Однако большинство точных механизмов работы компонентов данной системы является неисследованным и по сей день. До сих пор для ученых остается загадкой, как сигнальные молекулы, поступающие из кишечной флоры, преодолевают кровеносный барьер мозга, и каково прямое воздействие этих молекул на нервные центры в головном мозге.
Несмотря на малоизученность оси "кишечник-мозг", было установлено, что стресс приводит к нарушению динамического движения стенок кишечника, задерживая время для освобождения ЖКТ от пищи. Очевидно, такое нарушение негативно сказывается на усвоении питательных веществ для организма, например вышеупомянутых триптофана и серотонина. Экспериментальные результаты, полученные в опытах с животными, сейчас успешно применяются для лечения депрессии и стресса с применением специфических препаратов, направленных на улучшение работы кишечной микрофлоры. В этом смысле зародился новый концепт, называемый психобиотикой – целая отрасль, которая стремится найти инновационные способы помочь людям, страдающим от серьезных психологических отклонений.
Заключение
Хотите позаботиться о своем мозге? Для этого вам нужно позаботиться о своем желудке! Здоровое питание и соблюдение диеты не будут лишними и положительно скажутся на вашем здоровье в долгосрочной перспективе. К тому же, ведение активного образа жизни и занятие спортом не только уменьшают риск развития многих нейродегенеративных заболеваний, но и обеспечивают нормальное функционирование пищеварительной системы.
Ось "кишечник-мозг" – реально существующая связь между пищеварительной и нервной системами, показывающая, что они являются единым целом и влияют на нашу жизнь во всех смыслах. Мозг и кишечник далеки друг от друга, но даже так они остаются связанными!
Данной статьей мы завершаем цикл "В чем прелесть биологии". Рассказав об удивительных особенностях сна, тайных секретах микоризы, важности метаболизма глюкозы, мы надеемся, что вы смогли убедиться в прелести этой потрясающей науки. Однако наши статьи затронули лишь малую часть того огромного мира, что таит биология, и этот мир никогда не поздно начать для себя открывать!
Фонд «Beyond Curriculum» публикует цикл материалов «В чем прелесть предмета» в партнерстве с проектом «Караван знаний» при поддержке компании «Шеврон». Караван знаний – инициатива по исследованию и обсуждению передовых образовательных практик с участием ведущих казахстанских и международных экспертов.
Редактор статьи: Дарина Мухамеджанова
