[Прелесть химии] Неорганическая химия
![[Прелесть химии] Неорганическая химия](/content/images/size/w2000/2020/11/chem3.jpg)
Все статьи из цикла "В чем прелесть предмета"
Другие статьи из цикла "В чем прелесть химии":
Строительные блоки материи
Зачем учить физхимию?
Органическая химия
Полимеры
Синтез жизни
Чистый воздух
Химия и медицина: химическое оружие, аспирин и плесень
Предисловие
Обычно знакомство новоиспеченного ученика с химической наукой начинается с неорганической химии. Соответственно, большая часть школьной программы, как и большинство задач школьных олимпиад для \(7\)-\(9\) классов, сфокусирована на освоении неорганической химии элементов главной подгруппы периодической системы Менделеева. В старших классах, на более продвинутом уровне, вдобавок к органической химии ученики знакомятся уже с неорганической химией координационных соединений, терпеливо ожидающей своего часа не один год.
Так что же такого "продвинутого" может быть в неорганической химии?
В этой статье мы расскажем о действительно интересных аспектах так называемой «неживой химии». Кристаллы, кластеры, металлоорганическая и бионеорганическая химия – все это является областями крайне перспективных научных исследований, направленных на создание новых материалов, катализаторов, полупроводников, разработку новых методов лечения болезней и многого другого.
Лазурь, свет и координационные соединения
Органическая химия, о которой вы узнаете подробнее в следующей статье нашего цикла, изучает мириады различных соединений углерода. Если органическая химия сконцентрирована на изучении собственно органики, то неорганическая химия в широком смысле считается химией всего остального. Сюда входят все остальные элементы периодической системы, а также некоторые соединения углерода (\(CO\), \(CO_2\)), карбонильные комплексы металлов и углеродные нанотрубки.
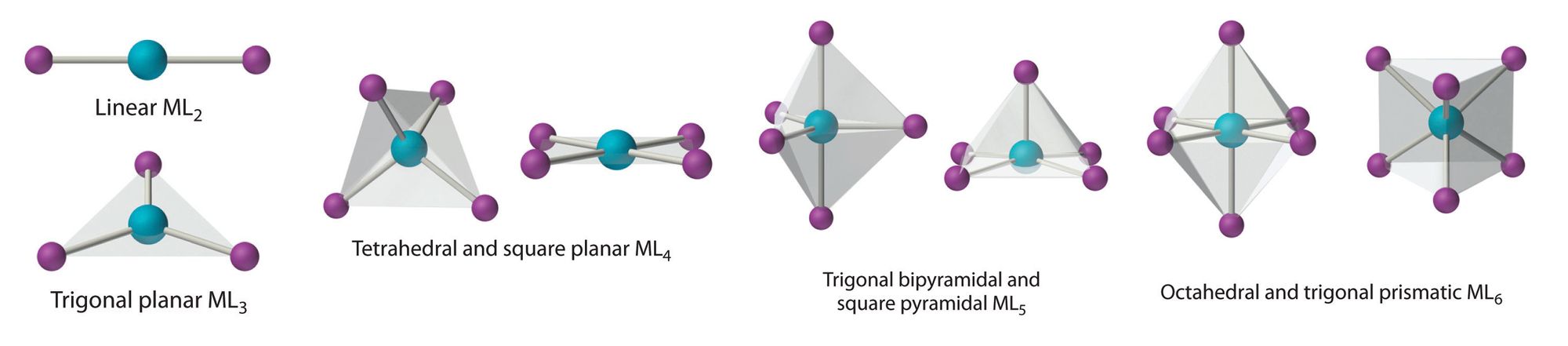
Одной из самых красочных и интенсивно исследуемых частей неорганической химии является химия координационных соединений. Классические координационные соединения, так называемые комплексы металлов, представляют собой линейные, плоские или же объёмные строения с центральным ионом металла, который окружен другими ионами или молекулами, обобщённо называемыми лигандами. Количество и сила образующихся связей в этих соединениях полностью зависит от перекрывания электронных орбиталей металлов и лигандов. Именно электронное строение центрального элемента по большей части определяет структуру соответствующего комплексного соединения, а также некоторые из его физических и химических свойств.
Лазурный берег, ляпис лазурит, лазурь – слова, наполненные чистейшими оттенками голубого. Этими же оттенками наполнена и берлинская лазурь – широко используемый голубой пигмент, состоящий из смеси комплексов железа, формирующихся из правильных шестигранников (октаэдров), в вершинах которых находятся цианид-ионы, а в центре – ион железа. Подобное окружение лигандами приводит к расщеплению (разделению) валентных d-орбиталей железа: энергия двух из пяти d-орбиталей повышается, а энергия остальных, наоборот, понижается. Подробнее этот процесс описывается теорией кристаллического поля и теорией поля лигандов.
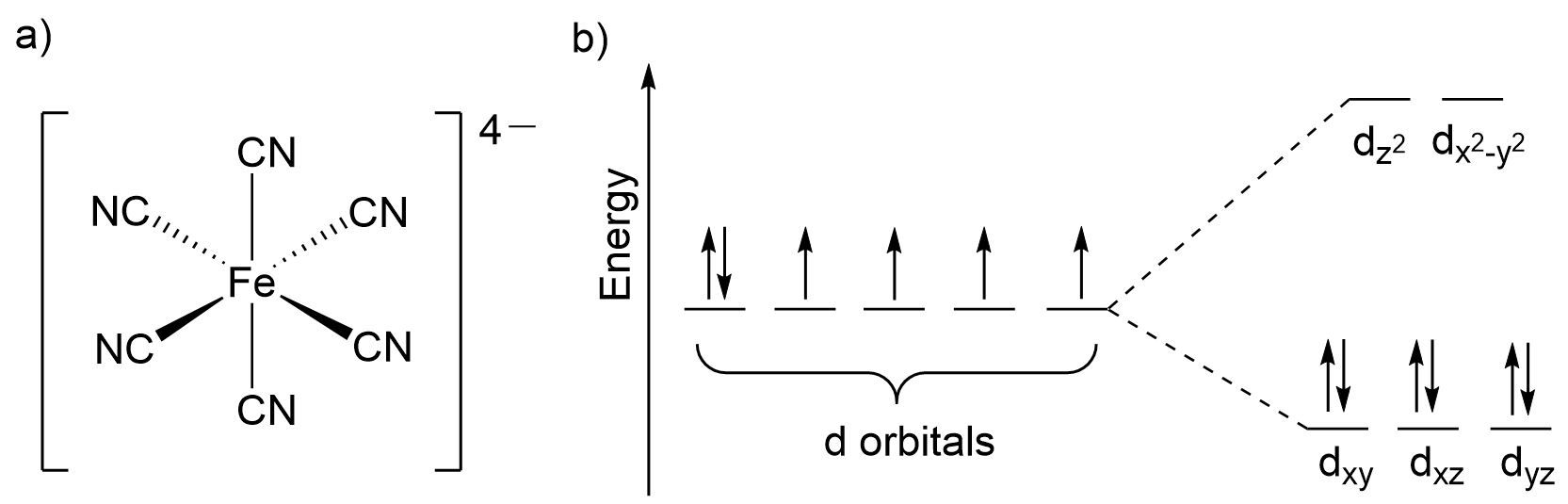
Теперь d-электроны способны "перепрыгивать" с основного нижнего состояния на верхнее возбуждённое, и обратно. Чтобы подобные переходы произошли, электрон должен поглотить или излучить фотон (частицу света) с достаточной энергией для перехода, то есть определенной длины волны. При попадании света на кристалл берлинской лазури поглощается оранжевый свет с длиной волны в пределе \(600\)-\(650\) нанометров, а остальной свет без оранжевой зоны отражается от поверхности. Таким образом, сетчатка глаза воспринимает данный пигмент синим – комплементарным оранжевому.

Если взять гораздо большее количество координированных металлов и покрыть получившийся кластер защитным полимерным слоем, то получатся соединения, напрочь размывающие грань между микро- и макромиром. Так устроены полупроводники, а точнее полупроводниковые наночастицы. Эта грань разделения является химической основой нанотехнологий, электроники и, в частности, является результатом исследования физических свойств в полупроводниковых кластерах селенида кадмия.
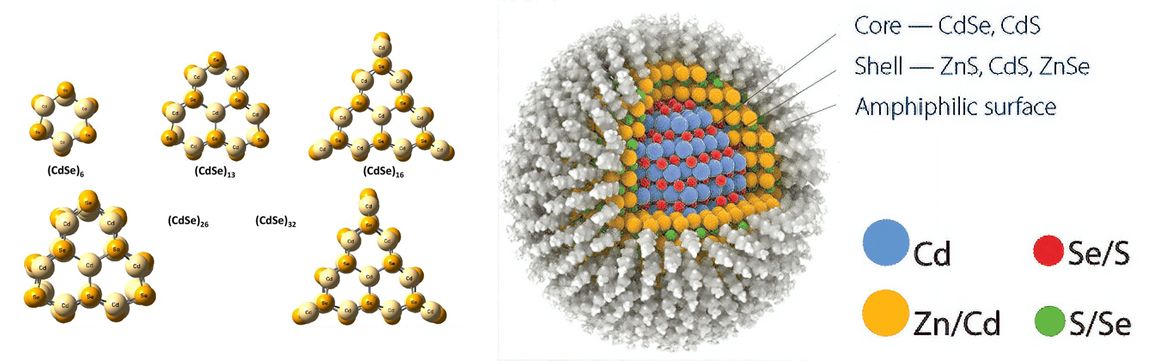
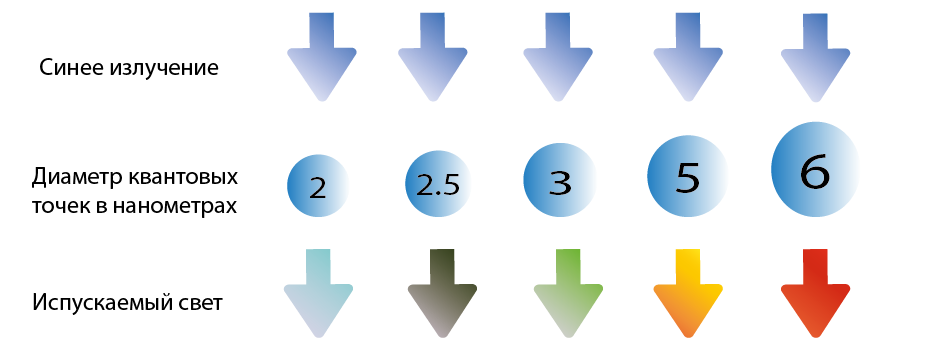
Интересно, что эти наночастицы, называемые квантовыми точками (англ. quantum dots), способны поглощать и выделять видимый свет благодаря электронным переходам, аналогичным в Берлинской лазури, и в зависимости от своих размеров люминесцировать каждый из цветов видимого спектра. Таким образом, увеличивающийся диаметр квантовой точки уменьшает разделение энергетических уровней при электронных переходах, что соответствует плавному изменению её люминесценции от фиолетового до красного цвета.
Квантовые точки имеют огромное множество применений, включая фотолюминесцентные красители, телевизионные дисплеи на светодиодах QD-LED, а также солнечные панели. В добавок, существует ряд потенциальных применений в биологических системах, например при получении медицинских изображений и проектировании молекул-доставщиков медицинских препаратов. Несмотря на проблему высокой токсичности неорганических компонентов квантовых точек, исследователи всё же сумели снизить риски потенциальных медицинских и экологических последствий за счёт улучшенных полимерных покрытий. Благодаря способности “подсвечиваться” более ярким светом, возбуждению широким спектром электромагнитных излучений и большей устойчивости к свету в сравнении с другими веществами, квантовые точки оказались чрезвычайно полезны в медицинских науках.

Кристаллы
Ещё одно важное свойство многих неорганических веществ – это формирование твёрдой кристаллической структуры, где каждый из составляющих атомов имеет определённое координационное окружение.
В природе кристаллы образуются осаждением различных ионов, содержащихся в подземных водах в виде минеральных кристаллов, таких как кварц (из кремния и кислорода), полевой шпат (из калия, алюминия, кремния и кислорода) и хлорид натрия. На самом деле, список не ограничивается минералами: песок, лёд, керамика, металлы, жидкие кристаллы и даже ДНК и белки тоже способны образовывать кристаллические структуры.
Основной особенностью кристаллов является их характерная геометрическая форма, как у каскада остроконечного кварца или кубиков хлорида натрия. Поваренная соль кристаллизуется именно в кубики не просто так! А всё потому, что бесконечно повторяющийся узор многих координационных соединений на атомарном уровне проявляется симметрией на макроуровне.

Важно отметить, что в зависимости от окружающих условий некоторые вещества с одинаковым химическим составом способны формировать совершенно разные кристаллы, и именно поэтому кристаллическая структура является определяющим признаком физических свойств кристаллов: твёрдости, цвета, прозрачности и многих других свойств кристаллов. Так, например, полиморфный диоксид кремния \(SiO_2\), известный своим множеством природных обличий, встречается в виде минералов кварца, тридимита, кристобалита и халцедона.

Металлоорганические каркасные структуры
А что будет, если связать органические молекулы с комплексами металлов в кристаллические структуры? Именно на стыке органических и неорганических химических концептов учёные смогли разработать высокоселективные пористые материалы – металлоорганические каркасные структуры (англ. metal-organic frameworks, MOF).
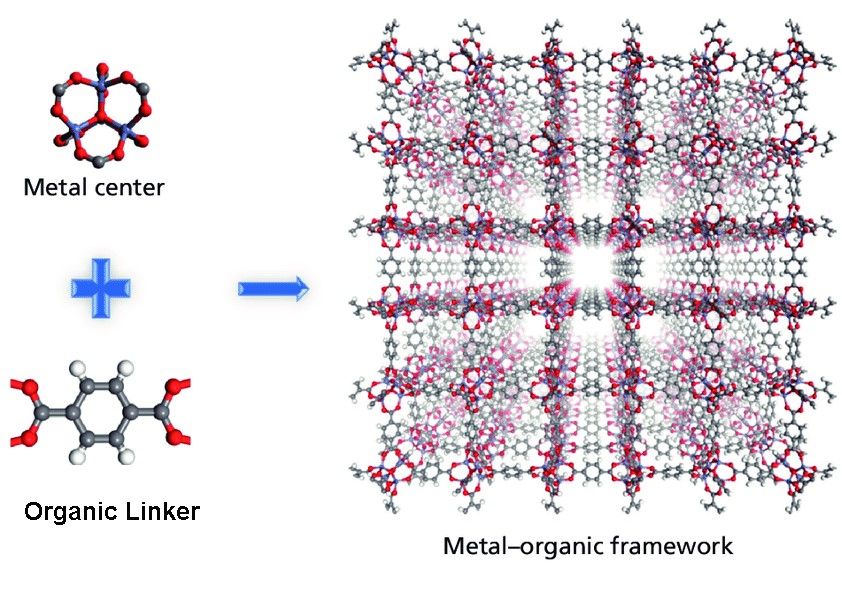
Исходя из примера самой детально исследуемой структуры MOF-\(5\), можно подметить связь между металлическими центрами, обозначенными голубыми тетраэдрами, атомами углерода, показанными серым цветом, и кислорода, показанными красным цветом. Важно отметить, что потрясающие адсорбционные свойства данного каркаса обусловлены большими кристаллическими порами, обозначенными желтыми сферами, диаметром в \(15.1\) и \(11.0\) ангстрем.
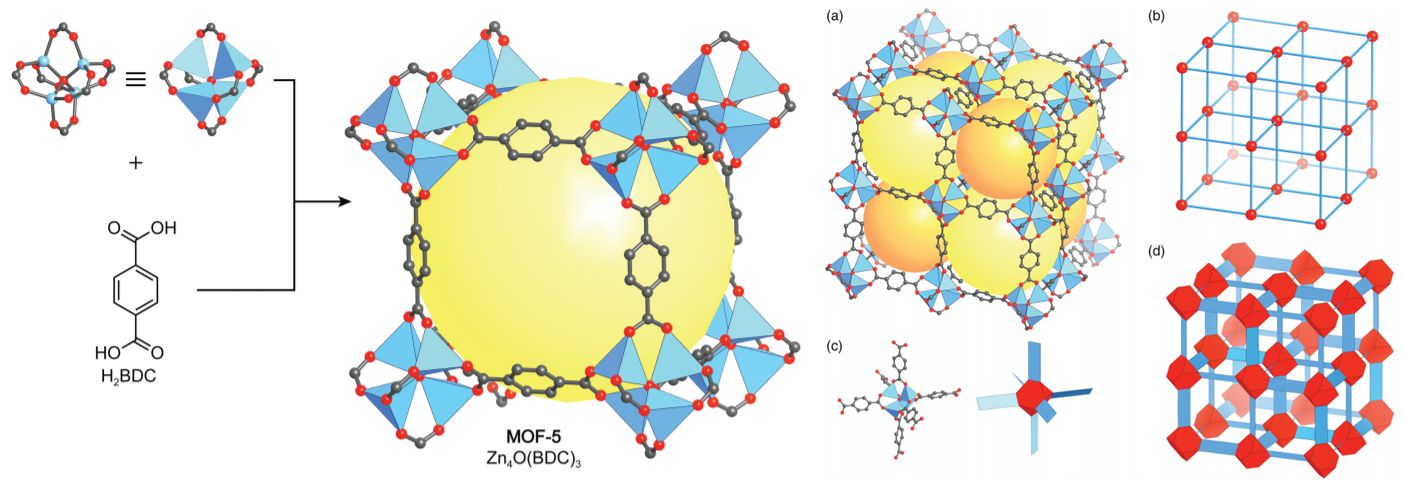
Благодаря своему структурному разнообразию и возможности регулирования как размера пор, так и их химической селективности, технологии MOF предоставили человечеству прекрасную возможность создания газоселективных мембран и эффективных адсорбционных материалов для хранения крайне перспективного и экологически чистого водородного топлива, пассивного сбора воды из воздуха и даже улавливания парниковых газов напрямую из атмосферы. В этом отношении, дальнейшие исследования металлоорганических каркасных структур однозначно сыграют существенную роль в реализации многих важных экологических стратегий.
Металлоорганические соединения
Другое слияние органических молекул с металлами породило широкий спектр металлоорганических соединений (англ. organometallic compounds), представляющих собой плавный переход между близко граничащими сферами химической науки – органикой и неорганикой. Давно известные человечеству металлорганические реактивы, вроде магнийорганических и литийорганических соединений, сыграли большую роль в зарождении органического синтеза природных и промышленных веществ. А в \(1973\) году металлорганика даже удостоилась признания в качестве отдельной области химии после присуждения Нобелевской премии немецкому учёному Эрнсту Фишеру (профессору Технического Университета в Мюнхене) и британскому учёному Джеффри Уилкинсону (профессору Лондонского Имперского Колледжа) за исследования сэндвичевых структур металлоценов.
Не стоит путать металлоорганические соединения с металлоорганическими каркасными структурами, в которых органические мостики связываются с ионами металлов посредством других элементов вроде азота, кислорода и серы, тогда как в металлоорганических молекулах необходимо наличие хотя бы одной прямой связи металл-углерод.
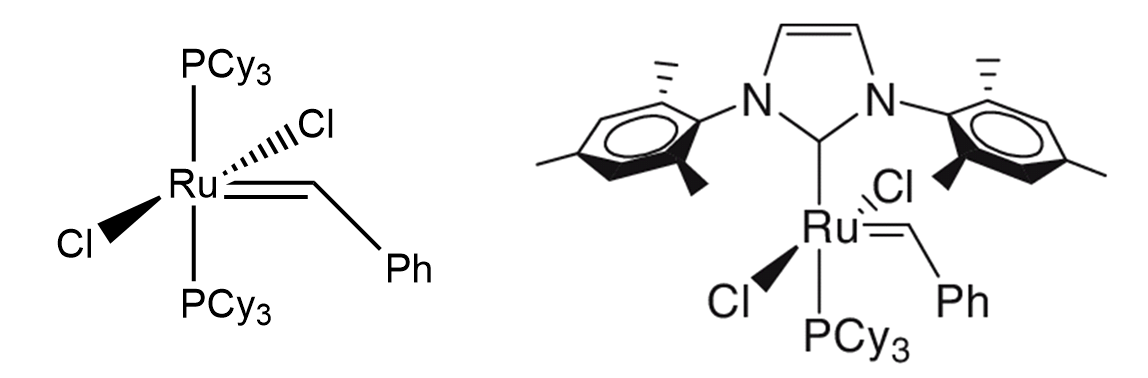
Помимо своей интересной природы, металлоорганические соединения выступают в роли утончённых катализаторов. Самые яркие примеры данных соединений привели своих первооткрывателей к заслуженным Нобелевским премиям по химии: за исследования высших полимеров катализаторами Циглера-Натта (\(1963\)), за метатезис олефинов катализаторами Граббса(\(2005\)), а также за реакции кросс-сочетания, катализируемые палладиевыми комплексами (\(2010\)). Все эти соединения позволяют с легкостью синтезировать многие сложные химические молекулы наподобие ингибитора образования раковых метастазов – вещества миграстатина.
На рубеже живого
Во многих школьных учебниках естествознания принято условно разделять наш мир на живую и неживую природу. Как раз большинство химических веществ, встречающихся в «неживой» природе, также встречаются и в живых организмах: кальций в костях, железо в крови, магний в хлорофилле растений и водорослей, кобальт в витамине B\(12\) и многие другие.
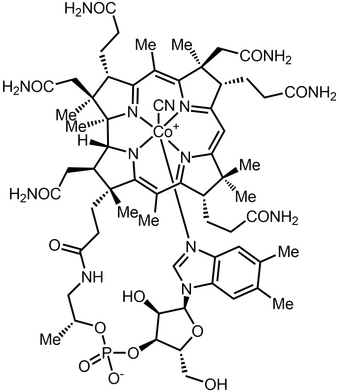
По своему научному определению бионеорганическая химия включает координационные соединения, встречающиеся в живых организмах, но в этот список включают и антропогенные вещества, такие как загрязнители (метилртуть) и лекарственные препараты (противораковый агент цисплатин) за счёт их заметного воздействия на живые системы.
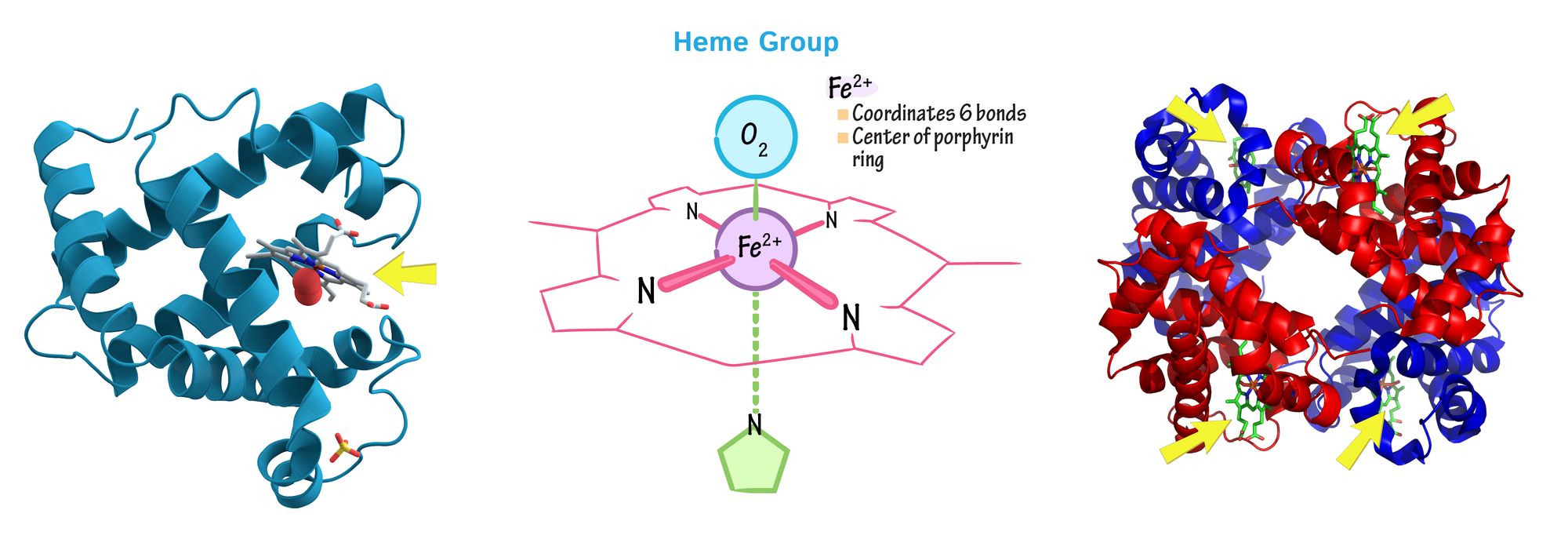
В целом, как смесь биохимии и неорганической химии, бионеорганика изучает механизмы биологических процессов на молекулярном уровне: действие белков в электронно-транспортной цепи, образование связи кислорода с гемоглобином в крови и миоглобином в мышцах, токсичность веществ и отравление, лечение нейродегенеративных болезней Паркинсона и Альцгеймера, а также большое множество всего остального.
Заключение
Вот так на мгновение мы окунулись в безграничный мир неорганической химии, которая оказалась не такой уж «неживой», а напротив, дышащей и активно растущей областью химической науки. Исходя из простой логики координационных соединений, мы увидели прямую связь неорганической химии с искусством, нанотехнологиями, кристаллами, органическими молекулами и живыми системами. Все это бесчисленное разнообразие вновь доказывает, насколько разносторонней является химическая наука, без которой не обойтись во многих научных и технологических начинаниях: будь то разработка лекарств, современных гаджетов или же создание красивейших красок для будущих шедевров.
Фонд «Beyond Curriculum» публикует цикл материалов «В чем прелесть предмета» в партнерстве с проектом «Караван знаний» при поддержке компании «Шеврон». Караван знаний – инициатива по исследованию и обсуждению передовых образовательных практик с участием ведущих казахстанских и международных экспертов.
Редактор статьи: Дарина Мухамеджанова
